Innehåll
I en kemisk reaktion omvandlas utgångsmaterialen, kallad reaktanter, till produkter. Medan alla kemiska reaktioner kräver en initial energitillförsel, kallad aktiveringsenergi, resulterar vissa reaktioner i en nettofrigörelse av energi i omgivningen, och andra resulterar i en nettobsorption av energi från omgivningen. Den senare situationen kallas en endergonic reaktion.
Reaktionsenergi
Kemister definierar deras reaktionskärl som "systemet" och allt annat i universum som "omgivningen". Därför, när en endergonic reaktion absorberar energi från omgivningen, kommer energin in i systemet. Den motsatta typen är en exergonisk reaktion där energi släpps ut i omgivningen.
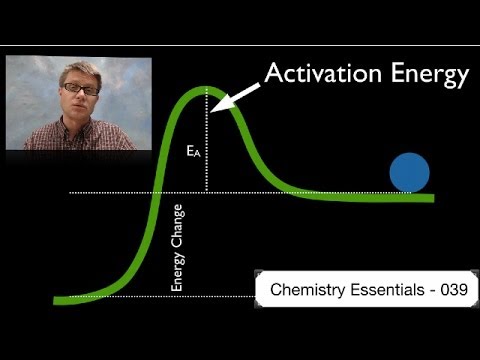
Den första delen av någon reaktion kräver alltid energi, oavsett reaktionstyp. Även om brinnande ved avger värme och spontant inträffar när det börjar måste du starta processen genom att lägga till energi. Den låga du lägger till för att starta vedbränningen ger aktiveringsenergin.
Aktiverings energi
För att komma från reaktantsidan till produktsidan av den kemiska ekvationen måste du övervinna aktiveringsenergibarriären. Varje individuell reaktion har en karakteristisk barriärstorlek. Barriärens höjd har inget att göra med om reaktionen är endergonisk eller exergonisk; till exempel kan en exergonisk reaktion ha en mycket hög aktiveringsenergibarriär, eller tvärtom.
Vissa reaktioner äger rum i flera steg, där varje steg har sin egen aktiveringsenergibarriär att övervinna.
exempel
Syntetiska reaktioner tenderar att vara endergoniska, och reaktioner som bryter ner molekyler tenderar att vara exergoniska. Exempelvis är processen för aminosyror som går samman för att framställa ett protein och bildandet av glukos från koldioxid under fotosyntes båda endergoniska reaktioner. Detta är meningsfullt eftersom processer som bygger större strukturer sannolikt kommer att kräva energi. Den omvända reaktionen - till exempel cellulär andning av glukos till koldioxid och vatten - är en exergonisk process.
katalysatorer
Katalysatorer kan minska aktiveringsenergibarriären för en reaktion. De gör det genom att stabilisera den mellanliggande strukturen som finns mellan den hos reaktanten och produktmolekylerna, vilket underlättar omvandlingen. I grund och botten ger katalysatorn reaktanterna en "energi" med lägre energi att passera genom, vilket gör det lättare att komma till produktsidan av aktiveringsenergibarriären. Det finns många typer av katalysatorer, men några av de mest kända är enzymer, katalysatorer från biologivärlden.
Reaktionsspontanitet
Oavsett aktiveringsenergibarriär inträffar endast exergoniska reaktioner spontant eftersom de avger energi. Ändå måste vi fortfarande bygga muskler och reparera våra kroppar, som båda är endergoniska processer. Vi kan driva en endergonic process genom att koppla den till en exergonisk process som ger tillräckligt med energi för att matcha skillnaden i energi mellan reaktanter och produkter.