Innehåll
För att helt enkelt deras beräkningar skapade kemister en standardenhet för antalet atomer i en viss förening som är involverad i en reaktion eller någon annan kemisk process. De definierar en mol (mol) som mängden av ett ämne som har samma antal grundenheter som 12 gram kol-12, vilket är Avogadros-nummer (6.022 × 1023). SI (metriska) mätsystem definierar en millimol (Mmol) som en tusendels mol. Du beräknar i allmänhet antalet mol av ett ämne genom att väga mängden du har till hands. Om du vill konvertera till Mmol multiplicerar du med 103 (1,000).
TL; DR (för lång; läste inte)
En mol är lika med Avogadros antalet partiklar av en speciell förening. En millimol (Mmol) är en tusendels mol.
Hur man beräknar mol
Atommassor mäts i atommassaenheter (AMU). En AMU är exakt 1/12 massan i kärnan i en kol-12-atom i dess marktillstånd. En mol av ett ämne definieras vara lika med Avogadros antalet partiklar av det ämnet. Enligt denna definition är vikten av en mol av ett ämne i gram samma antal som vikten för en enskild partikel av det ämnet i AMU. Till exempel är atomvikten för kol-12 12 AMU, så en mol kol-12 väger 12 gram.
Tänk på en behållare full av vätgas (H2). Varje partikel i behållaren är en molekyl som består av två väteatomer, så du behöver bara känna till atommassan för väte för att beräkna molekylvikten. De flesta versioner av den periodiska tabellen visar atomens massa för varje element under dess symbol. För väte, som har en enda proton i sin kärna, är dess 1,008 AMU, som är ett genomsnitt av alla de naturligt förekommande isotoperna av väte. Följaktligen är vätgasens atmassa 2,016 AMU och en mol vätgas väger 2,016 gram. För att hitta antalet mol i ditt prov skulle du väga provet i gram och dela den vikten med molekylvikten vätgas i gram. Till exempel innehåller ett prov som väger 15 gram ren vätgas 7,44 mol.
Konverterar till Mmol
Ibland är de kvantiteter som undersöks så små att det är besvärligt att uttrycka dem i mol. Ange millimolen. Genom att multiplicera antalet mol med tusen kan du konvertera ett mycket litet antal till ett mer hanterbart. Detta är särskilt bekvämt när man hanterar volymenheter i storleksordningen milliliter.
1 mol = 1 000 Mmol
Lösningskoncentration
Kemister använder molaritet som ett mått på koncentrationen av en viss förening i lösning. De definierar molaritet som antalet mol per liter. Du konverterar molaritet till millimolaritet genom att multiplicera med 1 000. Till exempel har en 1 mol (molär, även skriven som M) -lösning en koncentration av 1 mol per liter. Detta motsvarar en 1000 Mmol (millimolar, även ibland skriven som mM), som är en som innehåller 1 000 Mmol per liter.
Exempel
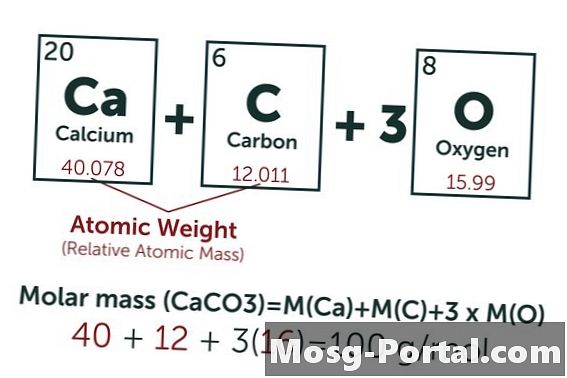
En lösning innehåller 0,15 gram kalciumkarbonat. Hur många millimol är det?
Den kemiska formeln för kalciumkarbonat är CaCO3. Atomvikten för kol (C) är ungefär 12 AMU, den för syre (O) ungefär 16 AMU och den för kalcium (Ca) ungefär 40 AMU. Varje molekyl kalciumkarbonat väger således 100 AMU, vilket innebär att en mol väger ungefär 100 gram. En vikt på 0,15 gram representerar 0,15 g ÷ 100 g / mol = 0,0015 mol. Detta motsvarar 1,5 Mmol.
Vad är molariteten och millimolariteten för detta mycket kalciumkarbonat i 2,5 liter lösning?
Molaritet definieras som antalet mol per liter, så del antalet mol med 2,5 för att få molariteten: 0,0015 ÷ 2,5 =
0,0006 M
Multiplicera med 1 000 för att få millimolaritet =
0,6 mM
Observera att du når samma resultat för millimolaritet om du delar antalet millimol med volym av lösning.