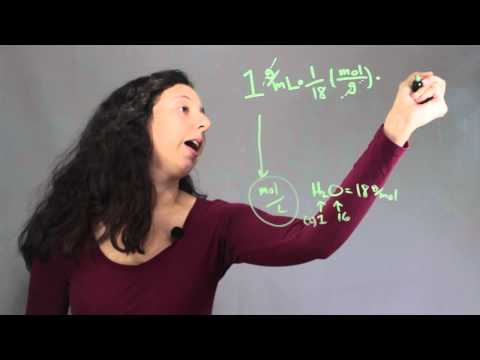
Innehåll
- TL; DR (för lång; läste inte)
- Definiera en mullvad och molaritet
- Konvertera molaritet till densitet
- Konvertera täthet till molaritet
Molaritet och densitet är olika sätt att uttrycka väsentligen samma sak. Medan densiteten är massan för ett fast ämne, vätska eller gas dividerat med dess volym, är molaritet antalet mol löst ämne per liter lösning. En mol av en förening är atommassorna för dess komponentatomer i gram, och en liter är ett mått på volym, så molaritet är också ett mått på densitet. Kemister föredrar att använda molaritet eftersom det gör att många ekvationer, till exempel den ideala gaslagen, kan tillämpas vid bredare omständigheter. Det gör dock vissa beräkningar enklare om alla kvantiteter är i täthetsenheter.
TL; DR (för lång; läste inte)
Molaritet är antalet mol löst ämne per liter lösning. Konvertera till densitet genom att multiplicera antalet mol med föreningens molekylmassa. Konvertera densitet till molaritet genom att konvertera till gram per liter och dela med föreningens molekylmassa i gram.
Definiera en mullvad och molaritet
En mullvad är en enhet som kemister använder för att mäta massa. En mol av vilken förening som helst har exakt samma antal partiklar som 12 gram kol-12, vilket är Avogadros-tal (6,02 x 1023) av partiklar. Massan för samma antal partiklar av vilken förening som helst beror på atommassorna i atomerna som bildar den. Till exempel. en mol vätgas (H2) har en massa på 2,016 gram, eftersom den genomsnittliga atommassan för alla väteisotoper är 1,008 AMU (atommasseenheter). På liknande sätt en mol metangas (CH4) har en massa av 16,043 gram, eftersom kolens massa, när du tar hänsyn till alla dess naturligt förekommande isotoper, är 12,011.
Kemister använder molaritet för att mäta koncentrationen av en löslig lösning. Molaritet (M) är antalet mol löst ämne i en liter lösning. Natriumklorid (NaCl) har en molekylmassa på (22,99 + 35,45) = 58,44 AMU, så om du löser upp 58,44 gram bordsalt i en liter vatten har du en 1 M (1 molar) lösning.
Konvertera molaritet till densitet
Molektiviteten hos ett löst ämne är ett mått på densiteten för det lösta ämnet, och du beräknar det ena från det andra ganska lätt. Betrakta exemplet med 1 M lösning av NaCl. Den innehåller 58,44 gram NaCl per liter lösning, så densiteten för NaCl i lösningen är 58,44 gram / liter. Om du istället har en 1,05 M NaCl-lösning, multiplicerar du helt enkelt molariteten med molekylmassan för NaCl för att hitta densiteten i gram per liter: (1,05 * 58,44) = 61,32 g / l. Beräkningarna är vanligtvis enklare om du konverterar densitet till gram / milliliter genom att multiplicera resultatet med 10-3. Så 58,44 g / l blir 0,05844 g / ml och 61,32 g / l blir 0,06132 g / ml.
Konvertera täthet till molaritet
Det omvända förfarandet, omvandling av densiteten för lösta ämnen i lösning till molaritet, är inte svårt. Konvertera den lösta densiteten till gram / liter och dela sedan resultatet med den lösta molekylmassan. Tänk till exempel på en lösning där densiteten för natriumklorid är 0,036 g / ml. Multiplicera med 103 att konvertera till g / l = 36 g / l. Dela med molekylvikten för NaCl (58,44 g): 36 g / l ÷ 58,44 g / mol = 6,16 mol / l = 0,62 M.