Innehåll
- Periodisk organisation
- Vetenskapliga skäl
- Alkali och alkaliska jordartsmetaller
- Övergångsmetaller
- Metalloider och icke-metaller
- Ädelgaser
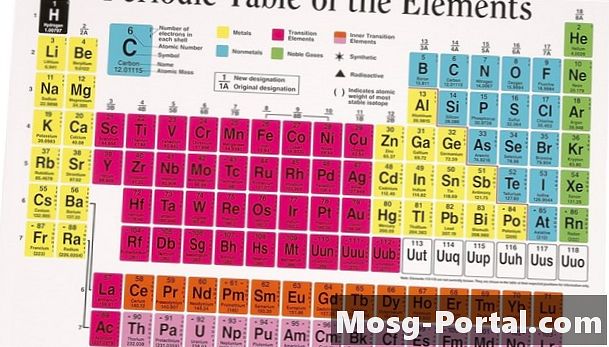
Den periodiska tabellen, som innehåller alla de naturligt förekommande och galna kemiska elementen, är den centrala pelaren i alla kemi klassrum. Denna klassificeringsmetod går till en bok från 1869, skriven av Dmitri Ivanovich Mendeleev. Den ryska forskaren märkte att när han skrev de kända elementen i ordning för att öka atomvikten, kunde han enkelt sortera dem i rader baserade på liknande egenskaper. Otroligt nog var likheterna så distinkta att Mendeleev kunde lämna utrymmen för flera oupptäckta element i hans periodiska klassificering.
Periodisk organisation
I den periodiska tabellen definieras ett element av dess vertikala grupp och horisontella period. Varje period, numrerad en till sju, innehåller element med ökande atomantal.Till skillnad från Mendeleevs ursprungliga lista, är den moderna periodiska tabellen baserad på atomnummer eller antalet protoner i en atomkärnans element. Protonnumret är ett logiskt val för att organisera elementen, eftersom protoner bestämmer en atoms kemiska identitet, medan atomvikten varierar med olika atomisotoper. Atten kolumner finns i den periodiska tabellen, ofta kallad grupper. Varje grupp innehåller flera element som har liknande fysiska egenskaper på grund av deras underliggande atomstruktur.
Vetenskapliga skäl
Atomen är den minsta delningen av materien som upprätthåller sin identitet som ett kemiskt element; den är av en central kärna omgiven av ett elektronmoln. Kärnan har en positiv laddning på grund av protonerna, som lockar de små, negativt laddade elektronerna. Elektronerna och protonerna är lika i antal för en neutral atom. Elektronerna är organiserade i orbitaler eller skal på grund av kvantmekanikens principer, som begränsar antalet elektroner i varje skal. Kemiska interaktioner mellan atomer påverkar vanligtvis endast de yttre elektronerna i det sista skalet, som kallas valenselektroner. Elementen i varje grupp har samma antal valenselektroner, vilket får dem att reagera på liknande sätt när de får eller förlorar elektroner till andra atomer. Elektronskalarna ökar i storlek, vilket orsakar den periodvisa storleken på periodiska tabellen.
Alkali och alkaliska jordartsmetaller
Den yttersta vänstra sidan av det periodiska systemet innehåller två grupper av mycket reaktiva metaller. Förutom väte består den första kolonnen av de mjuka, glänsande alkalimetallerna. Dessa metaller har bara en elektron i sitt valensskal, som lätt doneras till en annan atom i kemiska reaktioner. På grund av deras explosiva reaktivitet i både luft och vatten finns alkalimetallerna sällan i sin elementära form i naturen. I den andra gruppen har jordalkalimetallerna två valenselektroner, vilket gör dem något hårdare och mindre reaktiva. Men dessa metaller finns fortfarande sällan i sin elementära form.
Övergångsmetaller
Majoriteten av elementen i den periodiska tabellen klassificeras som metaller. Övergångsmetallerna ligger i mitten av bordet och sträcker sig från grupperna tre till 12. Dessa element är solida vid rumstemperatur, utom kvicksilver, och har den metalliska färgen och formbarheten som förväntas av metaller. Eftersom valensskalorna växer så stora utdrags några av övergångsmetallerna från det periodiska systemet och läggs till botten av diagrammet; dessa kända som lantanider och aktinider. Många av övergångsmetallerna nära botten av det periodiska systemet är sällsynta och instabila.
Metalloider och icke-metaller
På den högra sidan av det periodiska bordet delar en grov diagonal linje metallerna till vänster från de icke-metallerna till höger. På denna linje är metalloiderna, till exempel germanium och arsenik, som har vissa metalliska egenskaper. Kemister kategoriserar alla element till höger om denna skiljelinje som icke-metaller, med undantag för grupp 18 längst till höger. Många av de icke-metallerna är gasformiga, och alla är kända för deras tendens att få elektroner och fylla sina valensskal.
Ädelgaser
Grupp 18, längst upp till höger på det periodiska systemet, består helt av gaser. Dessa element har fulla valensskal och tenderar varken att vinna eller förlora elektroner. Som ett resultat existerar dessa gaser nästan uteslutande i sin elementära form. Kemister klassificerar dem som ädla eller inerta gaser. Alla de ädla gaserna är färglösa, luktfria och icke-reaktiva.