Atomer består av en tät kärna, eller kärna, som innehåller positivt laddade partiklar som kallas protoner och oladdade partiklar som kallas neutroner. Negativt laddade elektroner upptar något begränsade områden i rymden utanför kärnan som kallas orbitaler. Protoner och neutroner väger nästan 2000 gånger mer än elektroner och representerar därför nästan hela atomens massa. För varje givet element i det periodiska systemet är antalet protoner i kärnorna i dess atomer konstant. Till exempel innehåller varje kolatom sex elektroner. Antalet elektroner matchar antalet protoner i en neutral atom, men atomer kan få eller förlora elektroner under kemiska reaktioner. Antalet neutroner varierar också från atom till nästa. Kemister hänvisar till atomer av samma element med olika antal neutroner som isotoper. Att förstå dessa termer representerar nyckeln till att bestämma protoner, neutroner och elektroner i en isotop.
Identifiera massnumret på isotopen från dess symbol. Enligt konventionen anger forskare massantalet för en isotop som ett superskriptnummer framför elementens symbol, såsom 235U, eller med bindestreck efter symbolen, som i U-235.
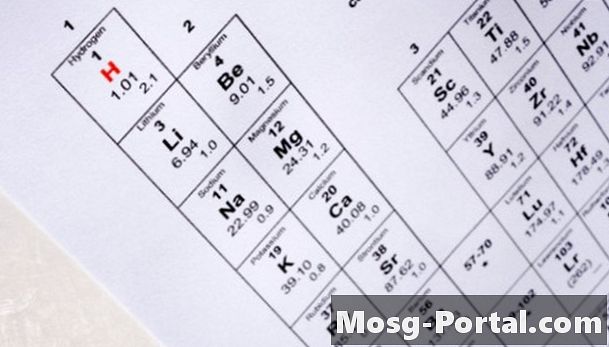
Bestäm antalet protoner i isotopens kärna genom att placera dess atumnummer på elementets periodiska tabell. Den periodiska tabellen ordnar element genom att öka atomantalet. U representerar till exempel den kemiska symbolen för uran och den har ett atomantal på 92. Detta betyder att alla uranatomer innehåller 92 protoner i deras kärna.
Beräkna antalet elektroner som isotopen innehåller genom att notera om dess symbol innehåller en laddning. Laddningsnotationen representerar antingen ett positivt eller negativt tal, vanligtvis skriven som ett superskript efter den kemiska symbolen, till exempel 235U (4+). Detta indikerar att uranatom har förlorat fyra elektroner. I avsaknad av en angiven laddning har isotopen en laddning på noll och dess antal elektroner är lika med dess antal protoner. Dra positiva laddningar från eller lägg till negativa laddningar till atomnumret om symbolen innehåller en angiven laddning. 235U (4+) skulle till exempel innehålla 92 - 4 = 88 elektroner.
Hitta antalet neutroner i isotopen genom att subtrahera antalet protoner från massnumret som anges i symbolen. Till exempel innehåller 235U, som innehåller 92 protoner, därför 235 - 92 = 143 neutroner.