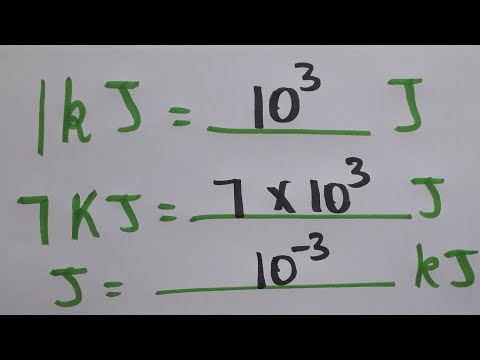
Innehåll
Skillnaden mellan värme och temperatur kan vara ett svårt begrepp att förstå. I huvudsak är värme den totala mängden kinetisk energi som molekylerna i ett ämne har och mäts i joules enheter (J). Temperaturen är relaterad till den genomsnittliga kinetiska energin för de enskilda molekylerna och mäts i grader. Att applicera samma mängd värme på olika material kommer att resultera i olika nivåer av temperaturökningar, beroende på ämnets specifika värmekapacitet. Du kan beräkna den slutliga temperaturen om du känner till mängden ämne och dess specifika värmekapacitet.
Dela mängden värmeenergi som tillförs ämnet, i joule, med ämnets massa, i gram (g). Till exempel, om 4 000 joule energi tillfördes 500 g vatten, skulle du beräkna 4 000/500 = 8.
Dela resultatet av den tidigare beräkningen med ämnets specifika värmekapacitet. Du kan generellt få den specifika värmekapaciteten för ett kemiskt ämne från tillverkarens litteratur eller från en vetenskaplig referenskälla, t.ex. CRC Handbook of Chemistry and Physics. Resultatet av denna beräkning är ämnets temperaturökning, i enheter av grader Celsius. Den specifika värmekapaciteten för vatten är g / 4,19 J - grader Celsius. I exemplet skulle beräkningen vara 8 / 4,19 = 1,9 grader Celsius.
Lägg till temperaturhöjningen som just härrör från ämnet. Detta ger dig temperaturen efter värmeingången.Om vattnet i exemplet ursprungligen hade varit 25 grader, skulle temperaturen efter uppvärmning vara 25 + 1,9 = 26,9 grader Celsius.
Tillsätt 273.1 till den slutliga temperaturen för ämnet som just beräknades. Detta är konverteringsfaktorn som ska ändras från enheter av grader Celsius till Kelvin (K). Resultatet är temperaturen på materialet efter värmetillförseln i kelvin. Vattentemperaturen skulle vara 26,9 + 273,1 = 300 K.