Innehåll
Kovalenta bindningar och vätebindningar är primära intermolekylära krafter. Kovalenta bindningar kan uppstå mellan de flesta element på det periodiska systemet. Vätebindningar är en speciell bindning mellan en väteatom och en syre-, kväve- eller fluoratom.
Valens
••• Jupiterimages / Photos.com / Getty ImagesKraften hos ett element att kombinera med andra element representeras av ett tilldelat nummer som kallas valensen. För joner är valensen lika med den elektriska laddningen. Till exempel är valensen för klor 3p5, så att den lätt får en elektron, och den resulterande jonen är Cl-.
Octetregeln


Oktetregeln är baserad på idén att ädelgasskonfigurationen (s2p6) är den mest gynnsamma och kan uppnås med bildandet av elektronpar-bindningar med andra atomer.
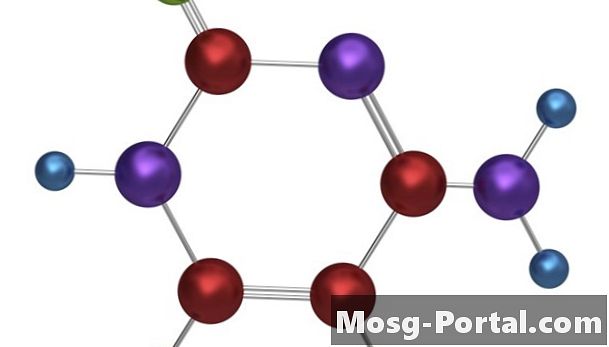
Kovalenta obligationer
••• Tempusfugit / iStock / Getty ImagesKovalenta bindningar bildas när två eller flera atomer delar elektroner för att fylla deras yttersta elektronskal.
Vätebindningar


En vätebindning uppstår när den partiella positiva laddningen av en väteatom binds till en elektronegativ molekyl, vanligtvis syre, kväve eller fluor.
Kovalenta v. Vätebindningar

Både kovalenta och vätebindningar är former av intermolekylära krafter. Kovalenta bindningar kan förekomma med de flesta element på det periodiska systemet, medan vätebindningar vanligtvis förekommer mellan en väteatom och en syre-, kväve- eller fluormolekyl. Dessutom är vätebindningar endast cirka 1/10 så starka som en kovalent bindning.