Innehåll
- TL; DR (för lång; läste inte)
- Propanklassificering
- Kemisk formel av propan
- Propanstruktur
- Egenskaper hos propan
- Användning av propan
Propan är ett fossilt bränsle och en del av naturgas. Över miljoner år bildades den från organiska rester av organismer och bryts från underjordiska avlagringar. Propangas är en organisk förening gjord av tre molekyler kolatomer bundna med åtta väteatomer. Typen av kol-kol kol-vätebindningar bestämmer strukturen för propanmolekyler, som följer samma mönster som andra typer av naturgaser som metan och butan.
TL; DR (för lång; läste inte)
TL; DR (för lång; läste inte)
Den kemiska formeln för propan är C3H8.
Propanklassificering
Propan klassificeras som en organisk förening eftersom den innehåller kol. Det kategoriseras vidare som ett kolväte eftersom det tillhör en grupp organiska föreningar som endast är gjorda av kol och väte. Mer specifikt är propan en typ av kolväte som kallas en alkan. Atomerna i alkanmolekyler hålls samman av enkla kovalenta bindningar, och kolatomer bildar alltid fyra kovalenta bindningar.
Kemisk formel av propan
Alkaner följer en allmän formel med ett bestämt förhållande mellan kolatomer och väteatomer: C_nH2_n+2. Den enklaste alkanen är metan, även känd som naturgas. Den innehåller en kolatom bunden till fyra väteatomer. För metan, n = 1, så antalet väteatomer som det har är lika med 2 (1) +2 vilket är lika med 4. Etan innehåller två kolatomer bundna samman, och varje kol är bundet till tre väteatomer för totalt sex väteatomer. Propan har en kedja med tre kolatomer, med en kemisk formel av C3H8, eftersom en kedja med tre kolatomer kräver 2 (3) +2 väteatomer, vilket är lika med åtta. Butan, en annan vanlig alkan som används som bränsle i handhållna gaslampor, har fyra kolatomer bundna med tio väteatomer, med en kemisk formel C4H10.
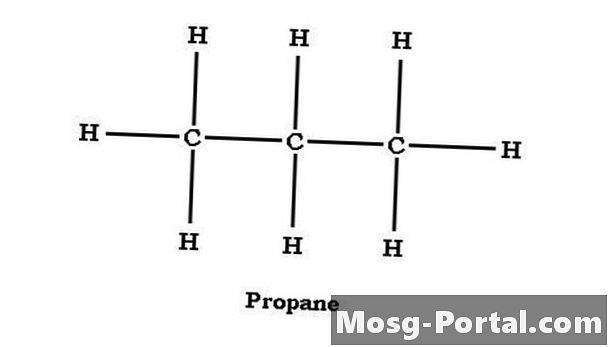
Propanstruktur
Alkaner kan struktureras som antingen rak eller grenad kedja. Propan är en rak kedja-alkan med kolatomerna strukturerade C-C-C. Det mittersta kolet delar en bindning med var och en av kolatterna och har två väteatomer. Ändkolhydraterna delar var och en en bindning med den centrala kolatomen och är båda bundna med tre väteatomer. När det gäller individuella kolatomer kan propan uttryckas som CH3CH2CH3, vilket motsvarar C3H8 men gör propanstrukturen mer tydlig.
Egenskaper hos propan
Förutom de strukturella likheter som delas av rakkedjiga alkaner, delar de också liknande egenskaper. Propan och andra kolväten är icke-polära. Den här egenskapen dikterar att de bara kan blandas med andra icke-polära ämnen. Till exempel tillverkas oljor och andra bränslen av en blandning av kolväten. De kommer inte att blandas med ett polärt ämne som vatten; attraktionen mellan molekylerna gör att olja och vatten separeras. Med rakkedjiga alkaner ökar kokpunkten och smältpunkten när antalet kolmolekyler ökar. Kokpunkten för propan är −44 grader Fahrenheit (−42 grader Celsius) och smältningen av −306 grader Fahrenheit (−189 grader Celsius). Metan, med endast ett kol, har en lägre kokpunkt än propan vid −164 grader Celsius. Octane har åtta kolatomer och en kokpunkt på 98 grader Celsius.
Användning av propan
På grund av dess låga kokpunkt finns propan normalt i dess gasformiga tillstånd. När den korrekta mängden tryck och temperatur appliceras på propan, genomgår den en process som kallas flytning som tvingar propangas till dess vätskeform. Propan kan förvaras som en vätska i trycksatta tankar långt över kokpunkten. Flytande propangas används som värmebränsle som bränns till kraftugnar och varmvattenberedare. Det används också som matlagningsbränsle för utomhusgasgrillar och gasdrivna kökugnar. Propangas är också en komponent i drivmedel som används i aerosolburkar. Propan används också som en komponent i vissa typer av lim, tätningsmedel och färg.